Finadyne Transdermal vet.
Wirkstoff
ATC-Code
Tierarten
Rind
Diagnosen
Zur Fiebersenkung in Verbindung mit bovinen Atemwegserkrankungen.
Zur Fiebersenkung in Verbindung mit akuter Mastitis.
Zur Verminderung von Schmerz und Lahmheit in Verbindung mit interdigitaler Phlegmone, Dermatitis interdigitalis und Dermatitis digitalis (Mortellaro).
Wartezeit
| Essbare Gewebe: | 7 Tage. |
| Milch: | 36 Stunden. |
Wegen der möglichen Kreuzkontamination von unbehandelten Tieren mit diesem Tierarzneimittel bei der Fellpflege (Ablecken) sollten behandelte Tiere über die gesamte Wartezeit von den unbehandelten Tieren separiert werden. Die Nichteinhaltung dieser Empfehlung kann zu Rückständen bei unbehandelten Tieren führen.
Dosierung und Art der Anwendung
Zum Übergießen.
Zur einmaligen Anwendung.
Die empfohlene Behandlungsdosis beträgt 3,33 mg Flunixin/kg Körpergewicht (entsprechend
1 ml/15 kg Körpergewicht). Die Dosierkammer der Flasche ist nach Kilogramm Körpergewicht kalibriert. Um eine korrekte Dosierung zu gewährleisten, sollte das Körpergewicht so genau wie möglich ermittelt werden.
Machen Sie sich mit den Anwendungshinweisen intensiv vertraut, bevor die Tiere behandelt werden, um die Handhabung des Behältnisses sicher zu beherrschen.
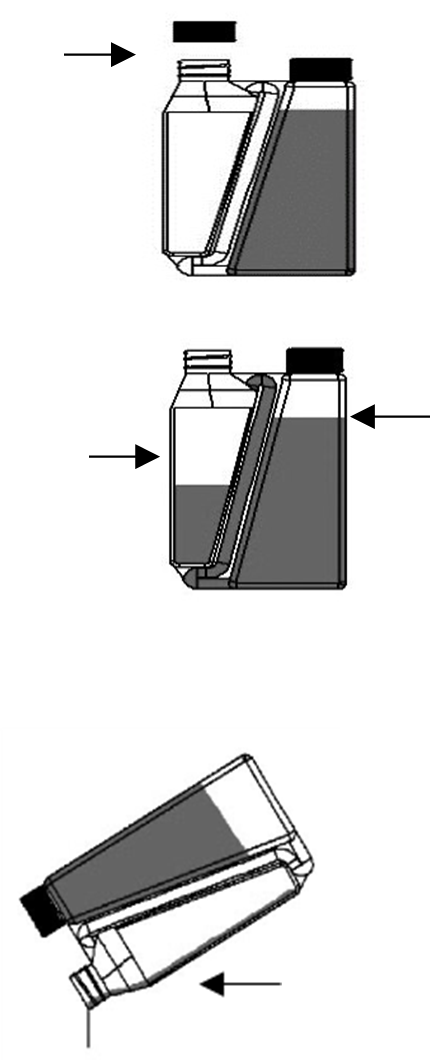
Schritt 1: Vor der ersten Anwendung Verschlusskappe von Nicht die Kappe der Dosierkammer abschrauben und das abziehbare der Flasche
Siegel entfernen. abschrauben.
Schritt 2: Flasche aufrecht und auf Augenhöhe halten. Dann
langsam und sanft die Flasche drücken, um die
Dosierkammer Dosierkammer bis zur gewünschten Markierung zu füllen.
Bei Überfüllung der Dosierkammer Anweisung zur Behebung einer Überfüllung befolgen.
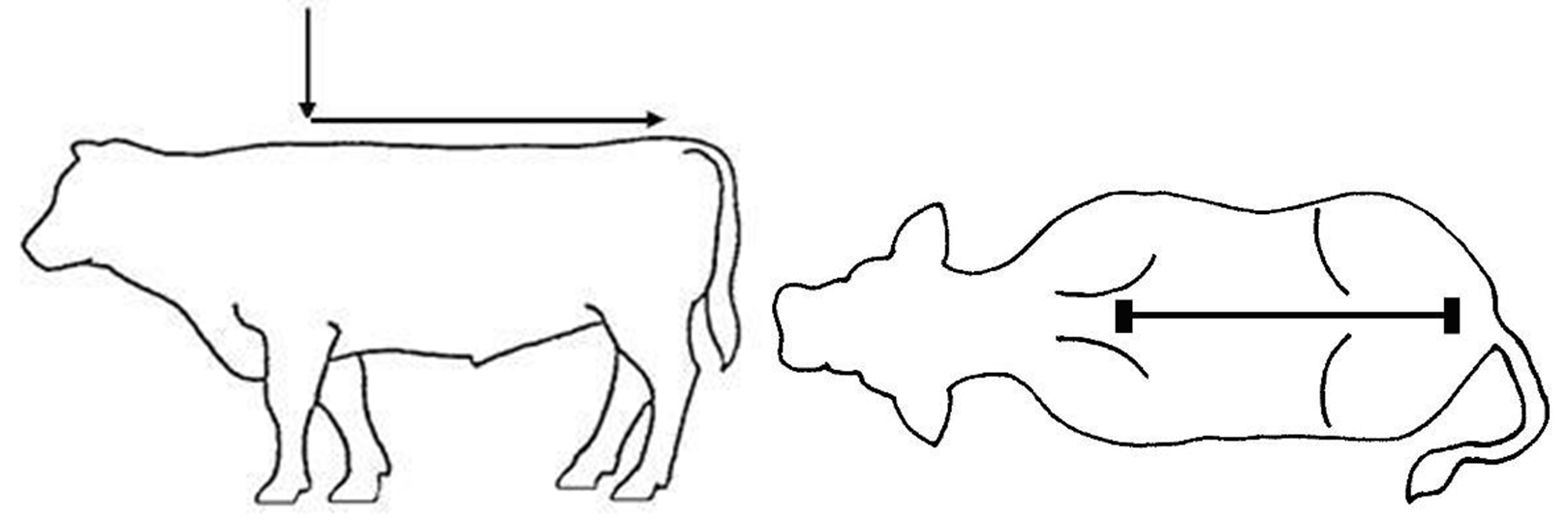
Schritt 3: Das abgemessene Volumen entlang der Rückenlinie des
Tieres vom Widerrist bis zur Schwanzwurzel aufgießen. Eine kleine
Flüssigkeitsmenge bleibt in den Wänden der Kammer zurück. Die
Kalibrierung der Kammer berücksichtigt dies. Das Drücken der Flasche während des Ausgießens der Lösung aus der Dosierkammer vermeiden.
Anweisung zur Behebung einer Überfüllung
Schritt 1: Verschlusskappe auf Dosierkammer setzen und zuschrauben.
Schritt 2: Die Flasche so schwenken, dass innerhalb der Flasche am Beginn des Transferröhrchens ein Luftraum entsteht.
 Schritt 3: Die Flasche horizontal halten, damit das Tierarzneimittel das Ende des Transferröhrchens innerhalb der Dosierkammer bedeckt.
Schritt 3: Die Flasche horizontal halten, damit das Tierarzneimittel das Ende des Transferröhrchens innerhalb der Dosierkammer bedeckt.
 Schritt 4: Die Flasche wiederholt
Schritt 4: Die Flasche wiederholt
drücken und wieder loslassen. Das Tierarzneimittel fließt durch das Transferröhrchen in die Flasche zurück.
.
Abbildung 1- Empfohlener Bereich für das Aufgießen
Nebenwirkungen
Rind
|
Häufig (1 bis 10 Tiere / 100 behandelte Tiere): |
Schwellung an der Applikationsstelle1, Erythem an der Applikationsstelle1, trockene Haut (Schuppen) an der Applikationsstelle1, Veränderungen des Haarkleides an der Applikationsstelle (abgebrochene/spröde Haare, dünnes Haar), Alopezie an der Applikationsstelle1, Hautverdickung an der Applikationsstelle1 Reizbarkeit2, Erregung2, gestörte Befindlichkeit2, |
|
|
Sehr selten (< 1 Tier/10 000 behandelte Tiere, einschließlich Einzelfallberichte): |
Anaphylaxie3 |
|
|
1 Diese Veränderungen wurden als vorübergehend gemeldet. Im Allgemeinen ist keine |
||
spezifische Behandlung erforderlich.
2 Vorübergehende Symptome
3 Kann schwerwiegend sein, kann auftreten und sollte symptomatisch behandelt werden
DE: Die Meldung von Nebenwirkungen ist wichtig. Sie ermöglicht die kontinuierliche Überwachung der Verträglichkeit eines Tierarzneimittels. Die Meldungen sind vorzugsweise durch einen Tierarzt über das nationale Meldesystem an das Bundesamt für
Verbraucherschutz und Lebensmittelsicherheit (BVL) oder an den Zulassungsinhaber zu senden. Die Kontaktdaten sind im Abschnitt „Kontaktangaben“ der Packungsbeilage angegeben. Meldebögen und Kontaktdaten des BVL sind auf der Internetseite https://www.vet-uaw.de/ zu finden oder können per E-Mail (uaw@bvl.bund.de) angefordert werden. Für Tierärzte besteht die Möglichkeit der elektronischen Meldung auf der oben genannten Internetseite.
AT: Die Meldung von Nebenwirkungen ist wichtig. Sie ermöglicht die kontinuierliche Überwachung der Verträglichkeit eines Tierarzneimittels. Die Meldungen sind vorzugsweise durch einen Tierarzt über das nationale Meldesystem entweder an den Zulassungsinhaber oder die zuständige nationale Behörde zu senden. Die entsprechenden Kontaktangaben finden Sie auch im Abschnitt 16 der Packungsbeilage.
Literaturhinweis

| STATUS | Im Handel verfügbar |
|---|
 VERIFIZIERTE DATEN
VERIFIZIERTE DATEN







